汉恒生物科技(上海)有限公司品牌商
17 年
手机商铺
- NaN
- 0
- 0
- 2
- 2
公司新闻/正文
表观遗传系列干货4丨RNA甲基化如何改写生命剧本
597 人阅读发布时间:2025-06-16 13:28
RNA甲基化修饰类型
RNA甲基化修饰类型繁多,其形式主要包括:N6-甲基腺苷(N6-methyladenosine,m6A)、N1-甲基腺苷(N1-methyladenosine,m1A)、5-甲基胞嘧啶(5-methylcytidine,m5C)、5-羟甲基胞嘧啶(5-hydroxymethylcytosine,hm5C)、N7-甲基鸟苷(N7-methylguanosine,m7G)、肌苷(Inosine,I)、2’-O-甲基化核苷(2'-O-Methyladenosine,Nm)、3-甲基胞嘧啶(5-methylcytidine,m3C)和假尿苷(Pseudouridine,Ψ)等类型,其中m6A、m1A、m5C、m7G是目前主要的研究热点。
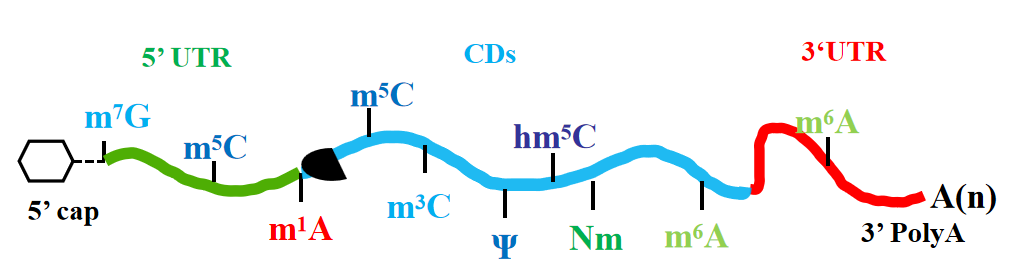
图1、 RNA甲基化修饰类型
m6A甲基化是发生在腺嘌呤(A)第六位氮原子上的甲基化修饰,是真核生物中研究最广泛的RNA甲基化修饰,主要位于mRNA蛋白编码序列和终止密码子附近3’非翻译区。
m1A甲基化是发生在腺嘌呤(A)第一位氮原子上的甲基化修饰,普遍存在于真核生物tRNA、rRNA和mRNA。
m5C甲基化是发生在胞嘧啶(C)碱基第五位碳原子上的甲基化修饰,这种修饰广泛存在于各种生物的mRNA、rRNA和tRNA中。
m7G甲基化是发生在鸟嘌呤(G)第7位氮原子上的甲基化修饰,这种修饰普遍存在于mRNA的蛋白编码区和5’帽结构区,以及rRNA、tRNA和miRNA等多种RNA分子中。
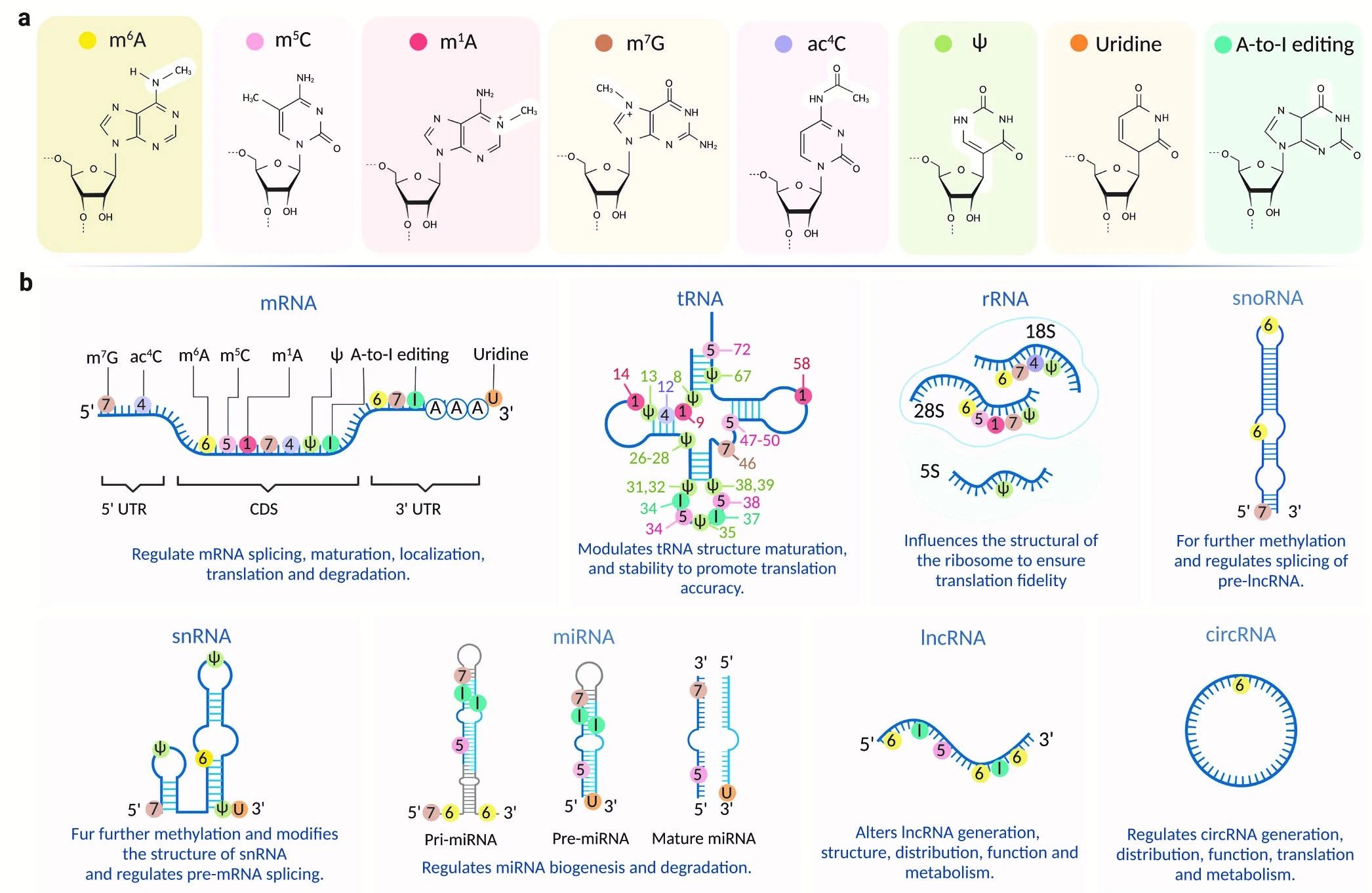
图2、RNA修饰及其在不同RNA亚型上的分布[1]
RNA甲基化的调控机制
RNA甲基化是一个动态可逆的过程,涉及多种蛋白质的协同作用,主要包括以下三种类型:甲基转移酶(Writer)负责在RNA上添加甲基基团;去甲基化酶(Eraser)负责去除RNA上的甲基基团;甲基识别蛋白(Reader)识别并结合RNA上的甲基化修饰,调控RNA的功能。目前已报道的甲基转移酶包括METTL3/14、WTAP、KIAA1429、VIRMA、PCIF1、NSUN5、DNMT2、TRDMT家族成员等,去甲基化酶包括ALKBH5、FTO、ALKBH1、TET酶家族等,甲基识别蛋白包括YTHDF1-3、YTHDC1-2、ALYREF、YBX1等。
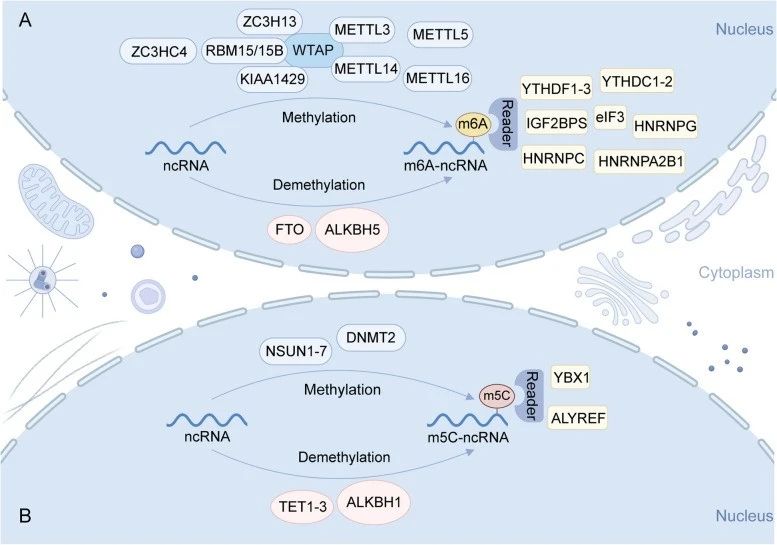
图4、m6A和m5C甲基化修饰机制图[2]
表1 常见的RNA甲基化修饰相关酶[3,4]

RNA甲基化的生物学功能
RNA甲基化修饰是一个复杂的调控机制,不同的RNA甲基化修饰类型存在于不同类型的RNA中,这些影响共同维持着细胞内RNA的稳态和功能,对发育、细胞分化、基因表达和基因组稳定性等至关重要。
m6A修饰广泛影响不同RNA类别的命运,进而调控各种细胞过程[3,6]。在mRNA中,m6A甲基化可影响剪接、输出、稳定、降解和翻译。在rRNA中,18 S rRNA中的A1832甲基化和 28S rRNA中的A4220甲基化对翻译至关重要。在miRNAs中,m6A可通过招募DGCR8促进pri-miRNA的加工,或通过某种排他性机制下调控多个miRNAs。在lncRNAs中,m6A修饰可作为结构开关调节RNA与蛋白质的相互作用,或稳定lncRNAs以确保其功能。在cirRNAs中,m6A可促进细胞质输出、翻译和降解。此外,m6A还参与调节snRNA的剪接和生物生成。
m1A甲基化与RNA稳定性、翻译等相关[3,5,6],在tRNA中,影响tRNA的稳定性和功能,促进其与核糖体的结合,提升翻译效率。在rRNA中帮助维持核糖体结构,确保翻译的准确性。在mRNA中,m1A分布在每个mRNA片段中,包括编码序列(CDS)、5'UTR和3'UTR,其作用似乎取决于区域或亚细胞位置。在起始密码子附近,m1A可能通过改变二级/三级结构或识别蛋白对翻译启动位点(TISs)的识别来调节翻译启动,从而促进翻译。线粒体中5'UTR或CDS中的m1A抑制翻译,可能是通过影响核糖体扫描或翻译。另外,m1A可以增强mRNA的稳定性,延长其半衰期。
m5C广泛分布在rRNA和tRNA变区和反密码loop上,通过调控tRNA稳定性和密码子识别、翻译保真度和准确性或全局蛋白质合成等参与翻译调控[7]。mRNA上的m5C也参与调控翻译效率,在3T3-L1细胞中,NSUN2以m5C依赖的方式促进CDKN1A mRNA的翻译效率。此外,m5C也在mRNA出核中发挥关键作用。
mRNA上的m7G帽调节mRNA过程的多个阶段[3,6],包括pre-mRNA剪接、出核、转录扩展、翻译和降解,并间接增加核糖体合成和翻译效率。在内部mRNA上,m7G甲基化可能影响mRNA翻译。tRNA中,m7G通过维持tRNA结构完整性来重塑mRNA翻译体,促进其稳定性、翻译能力。在rRNA中,m7G修饰参与核糖体的组装和功能,影响蛋白质合成的精度和效率。
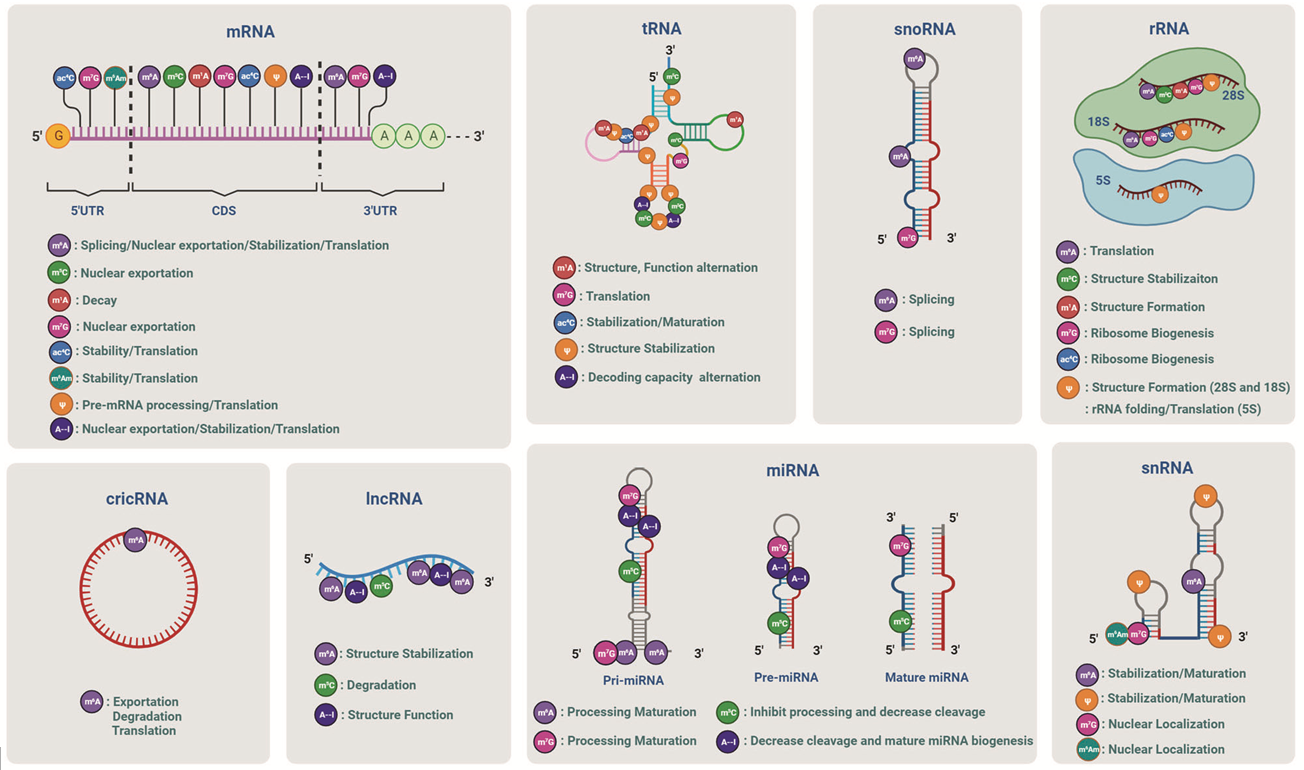
图3、常见的RNA修饰的生物学功能[3]
RNA甲基化与疾病的关系
RNA甲基化修饰失调导致RNA的功能紊乱,引发一系列机体的病理效应。目前的研究已证实,RNA甲基化修饰与多种疾病如肿瘤、神经系统疾病、免疫相关疾病、心血管疾病等密切关联。
(1)RNA甲基化与肿瘤
大量研究表明,RNA甲基化在多种癌症的发展和进展中至关重要,包括乳腺癌、肺癌、结直肠癌、肝细胞癌、胃癌、食管癌、前列腺癌、膀胱癌、卵巢癌、急性髓系白血病、胰腺癌等,突显了其在恶性肿瘤中的关键作用。Zhou等[8]证实METTL3通过m6A-YTHDF2依赖性方式抑制抑癌基因YPEL5的表达,影响结直肠癌细胞增殖和细胞周期进程的调节。MA等[9]研究发现METTL1/WDR4 在肺癌中表达上调,并在体内外促进肺癌进展,且与患者预后呈负相关,其机制可能是METTL1和WDR4复合物通过依赖于m7G tRNA 的密码子发挥致癌作用,同时还影响细胞周期相关的mRNA翻译,包括CCND3和CCNE1在内的细胞周期蛋白,提示 tRNAm7G修饰是重要的致癌因子。此外,在肿瘤中,m6A修饰通过调控免疫细胞的功能,如巨噬细胞的极化、树突状细胞的活化和T细胞的分化,影响肿瘤免疫应答。此外,RNA甲基化还通过调节糖酵解、脂肪代谢和氨基酸代谢来重塑肿瘤微环境(TME)促进肿瘤免疫逃逸[1]。
(2)RNA甲基化与神经系统疾病
RNA修饰在神经系统中的广泛存在及其参与多个调控机制决定了其对于神经系统正常生理功能发挥着重要作用。RNA修饰异常可诱发多种神经退行性疾病并导致神经功能障碍,脑卒中、阿尔茨海默病、帕金森病、智力障碍、注意力缺陷多动障碍、脑部肿瘤等都是与RNA修饰调控异常有关的病症。常见的RNA修饰如m6A、m1A、hm5C修饰都被证实参与了脑卒中后神经炎症反应的调控,影响了炎症因子的表达和细胞炎性反应[10]。
(3)RNA甲基化与免疫相关疾病
RNA甲基化通过调控免疫细胞的分化、功能以及炎症因子的表达,在自身免疫性疾病、感染性疾病和癌症免疫中发挥重要作用,目前已成为免疫相关疾病中的研究热点。m6A甲基转移酶复合物(MTC)中的METTL3等蛋白在类风湿性关节炎和系统性红斑狼疮中的异常表达可能导致疾病的进展和严重程度。
(4)RNA甲基化与心血管疾病
RNA甲基化通过调控基因表达、RNA稳定性、翻译效率等过程,影响心血管细胞的生理功能和病理过程,从而参与心血管疾病的发生和发展。m6A甲基转移酶METTL3通过调控心肌细胞中关键基因(如MYH7、MYH6)的表达,影响心肌细胞的功能和结构[11]。m6A去甲基化酶ALKBH5在心肌梗死后表达异常,通过调控多种靶基因的表达,参与多种细胞包括心肌细胞、成纤维细胞、内皮细胞、间充质干细胞的增殖、凋亡、自噬和铁死亡等过程[12-14]。Tang等[15]发现m5C甲基化酶Nsun2在心肌细胞中高表达,且在病理性心肌肥厚模型中表达上调,特异性敲除Nsun2的小鼠表现出心脏功能异常,机制上,Nsun2通过催化PRKACA (蛋白激酶A的催化亚基)mRNA的m5C修饰,增强其稳定性和翻译效率进而调控PRKACA的表达,影响心肌细胞的功能和病理性肥厚反应。
RNA甲基化的检测方法
随着RNA甲基化修饰在生物学中的重要性日益凸显,检测RNA甲基化水平的方法也日趋完善。目前,RNA甲基化检测策略可分为三大类:全局检测、转录组检测、位点特异性检测。全局检测主要用于探究总甲基化水平变化与特定表型或状态间的联系,常用技术包括基于酶联免疫吸附试验(ELISA)的比色法、液相色谱-串联质谱(LC-MS/MS)、薄层色谱(TLC)及点杂交(Dot-blot)。转录组检测类似基因组学中的高通量测序,如MeRIP-seq、miCLIP、eTAM-seq等提供转录组甲基化位点信息。位点特异性检测基于预存数据验证甲基化并精确定位,如SCARLET法结合TLC和位点特异性RNase H消化,可单核苷酸分辨率探测m6A。基于半定量qPCR的方法利用修饰核苷酸阻碍逆转录酶延伸的特性检测m6A。SELECT法能在单核苷酸水平检测,适用于m6A、m1A及2'-O-甲基化(Nm)。
表2. RNA甲基化常见检测方法比较[16]
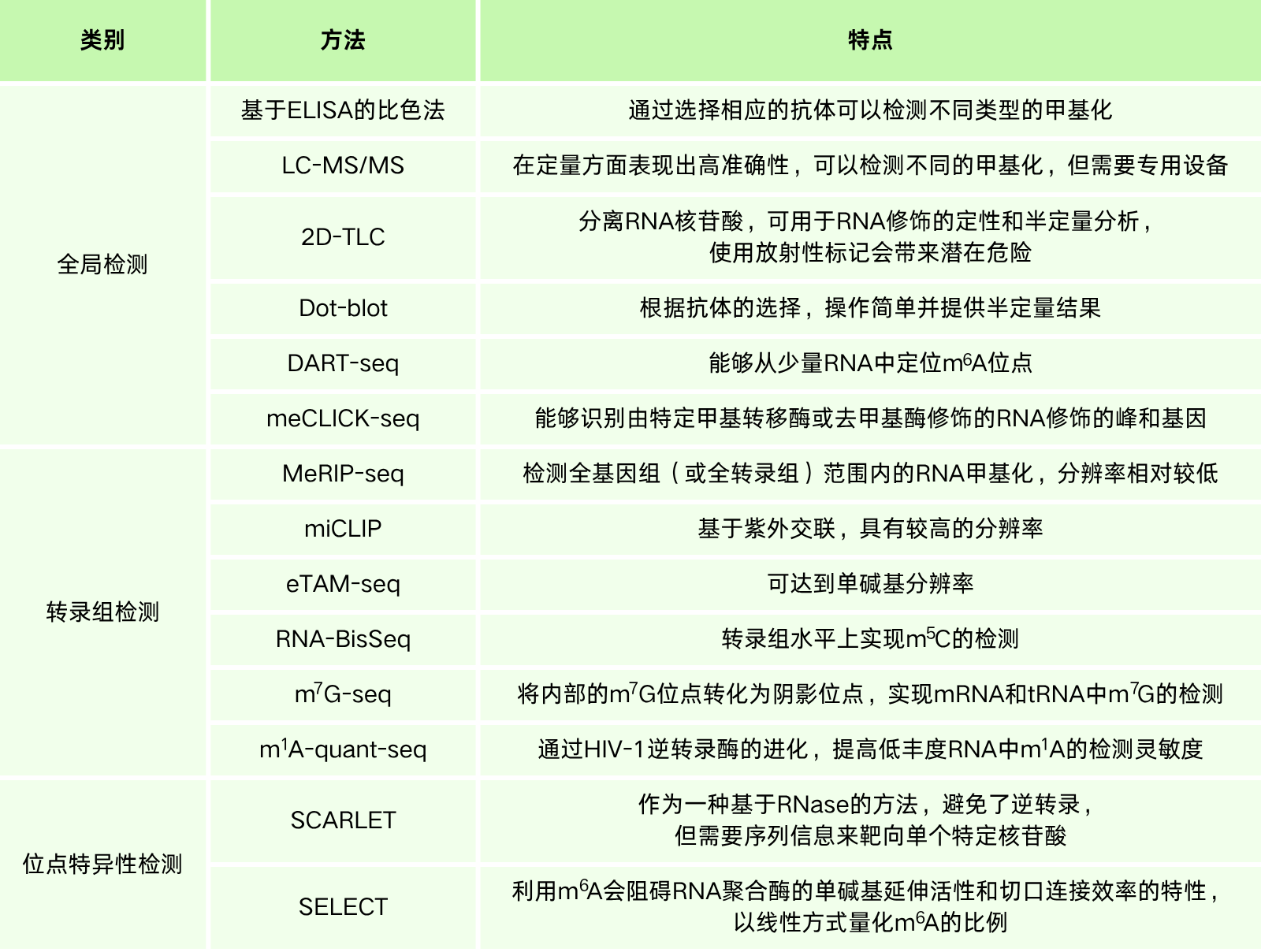
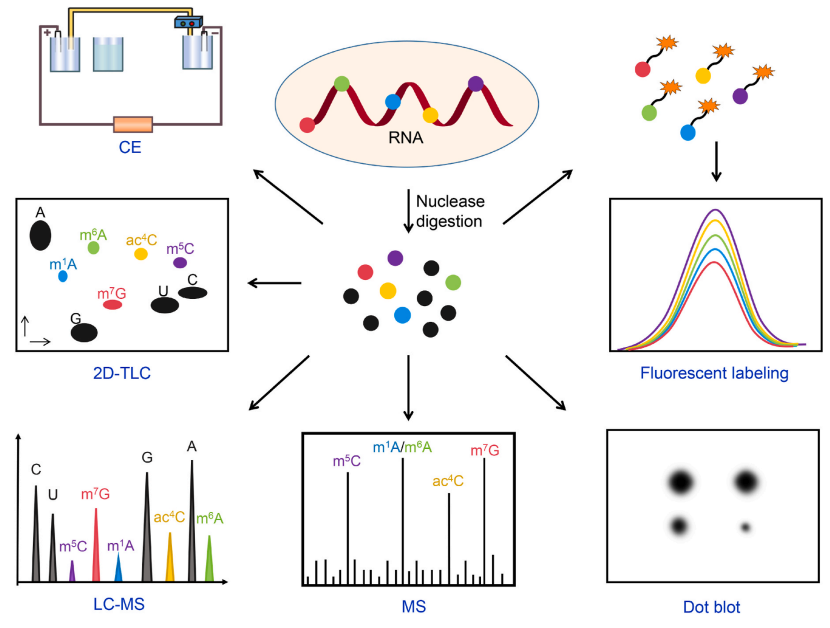
图5. RNA修饰总体水平定量方法示意图[17]
RNA甲基化的临床应用
随着对RNA甲基化修饰的深入研究,RNA甲基化(如m6A、m5C等)在临床应用中显示出巨大潜力,特别是在疾病诊断、治疗和预后评估方面。
1)疾病诊断和监测
RNA甲基化,特别是m6A修饰,在肿瘤中的变化已被广泛用于诊断和监测。如胃癌患者外周血m6A水平显著高于健康体检者和胃良性疾病患者;同时,晚期患者显著高于早期患者,转移患者显著高于非转移患者。这种修饰的检测可以帮助早期诊断胃癌,并监测病程进展。此外,m6A修饰的水平变化还与胃癌的分期和转移状态相关。
2)疾病治疗
RNA甲基化修饰及其相关的酶和蛋白被认为是潜在的治疗靶点。FTO作为一种去甲基酶,其抑制剂已被证明能够通过抑制肿瘤细胞的糖酵解进程,逆转CD8+T细胞的活化和效应状态。结合FTO抑制剂和抗PD-L1治疗,有望显著提高抗肿瘤免疫反应。此外,针对METTL3和FTO的几种小分子抑制剂,包括STM2457、Alk-04、FB23-2和Dac51等,可以抑制m6A甲基化过程,并应用于AML的治疗。这些小分子抑制剂联合免疫检查点阻断疗法,有望提高AML患者的治疗效果。
3)疾病预后
RNA甲基化修饰的水平变化可以用来评估患者的预后。非小细胞肺癌患者中,外周血白细胞中m6A修饰的水平与疾病的分期和预后密切相关。高水平的m6A修饰通常与较差的预后相关。此外,m7G修饰甲基化转移酶METTL1在去势抵抗前列腺癌患者癌组织和细胞株中表达较激素敏感患者明显升高,且高表达患者预后更差。
相较于DNA甲基化修饰,RNA甲基化修饰的研究相对较晚起步,但近年来随着技术的不断进步和研究的深入,其在生命科学领域中的重要性逐渐被认识和重视,RNA甲基化研究已成为生命科学最热门的焦点之一。本期内容主要为大家介绍了RNA甲基化相关的机制、功能、检测方法及其与疾病的关系,深入对RNA甲基化在疾病中的功能及机制研究,有助于为疾病治疗提供新的视角。
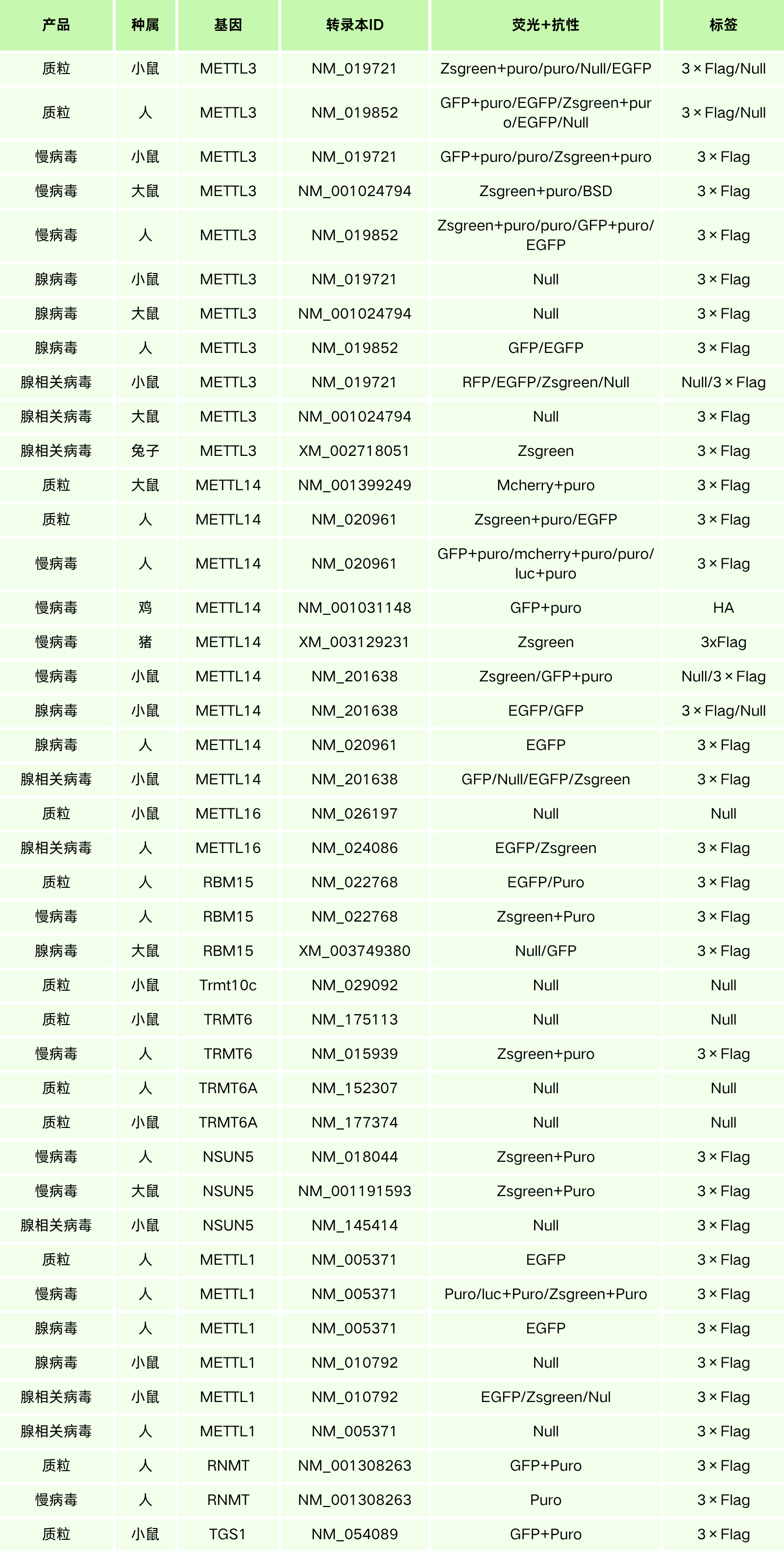
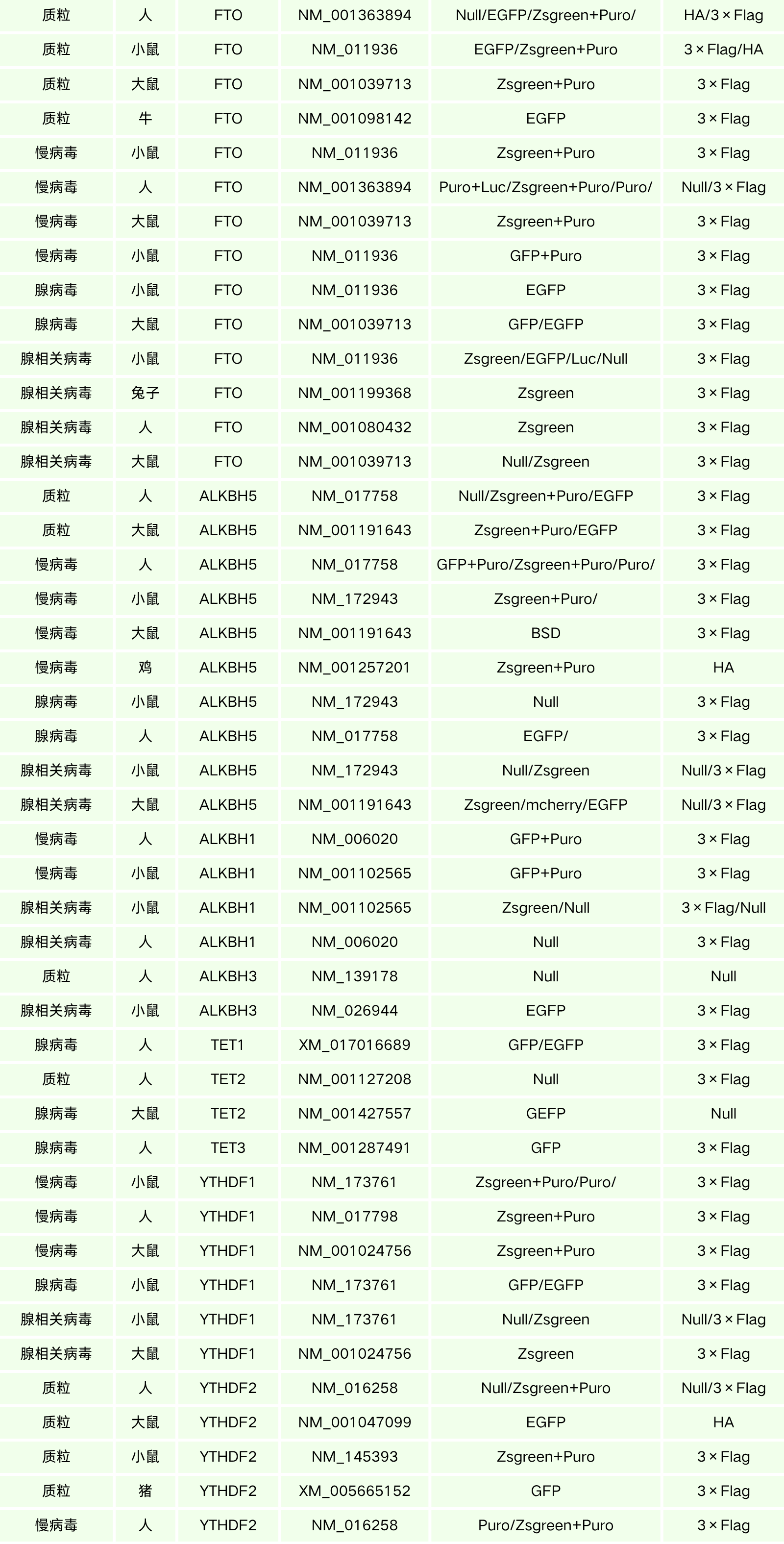
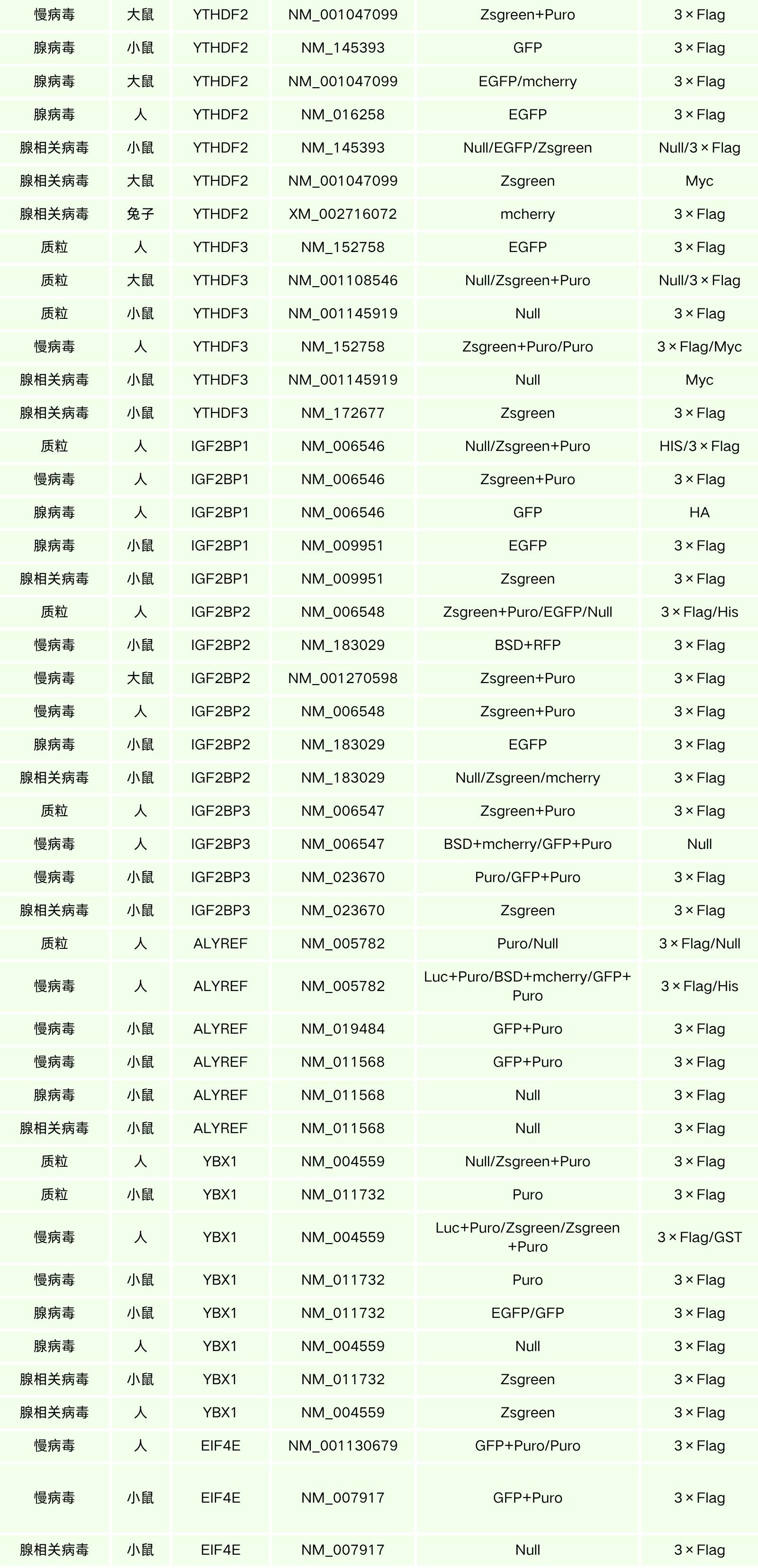
汉恒生物专营病毒包装十余载,建立了庞大的基因研究现货工具库,现可提供RNA甲基转移酶、去甲基化酶以及甲基识别蛋白等基因表达调控工具(见表3),也可定制靶向特异性组织或细胞的基因调控工具,包括慢病毒(Lentivirus, LV)、腺病毒(Adenovirus, AD)、腺相关病毒(Adeno-associated-virus, AAV)以及质粒等,如有技术或产品需求,欢迎随时咨询汉恒生物微信公众号或拨打官网技术服务热线:400-092-0065。本期内容到这里就结束了,下期我们将会分享细胞凋亡相关的酶家族,敬请关注。
表3. 汉恒生物RNA甲基化相关基因现货
参考文献
[1] Cui, L., Ma, R., Cai, J. et al. RNA modifications: importance in immune cell biology and related diseases. Sig Transduct Target Ther 7, 334 (2022). https://doi.org/10.1038/s41392-022-01175-9.
[2] Yang W, Zhao Y, Yang Y. Dynamic RNA methylation modifications and their regulatory role in mammalian development and diseases. Sci China Life Sci. 2024 Oct;67(10):2084-2104. doi: 10.1007/s11427-023-2526-2. Epub 2024 May 31. PMID: 38833084.
[3] Liu, WW., Zheng, SQ., Li, T. et al. RNA modifications in cellular metabolism: implications for metabolism-targeted therapy and immunotherapy. Sig Transduct Target Ther 9, 70 (2024). https://doi.org/10.1038/s41392-024-01777-5.
[4] Xia W, Liu Y, Lu J, Cheung HH, Meng Q, Huang B. RNA methylation in neurodevelopment and related diseases. Acta Biochim Biophys Sin (Shanghai). 2024 Sep 27;56(12):1723-1732. doi: 10.3724/abbs.2024159. PMID: 39344412; PMCID: PMC11693867.
[5] Boulias K, Greer EL. Biological roles of adenine methylation in RNA. Nat Rev Genet. 2023 Mar;24(3):143-160. doi: 10.1038/s41576-022-00534-0. Epub 2022 Oct 19. PMID: 36261710; PMCID: PMC9974562.
[6] Li Y, Jin H, Li Q, Shi L, Mao Y, Zhao L. The role of RNA methylation in tumor immunity and its potential in immunotherapy. Mol Cancer. 2024 Jun 20;23(1):130. doi: 10.1186/s12943-024-02041-8. PMID: 38902779; PMCID: PMC11188252.
[7] Shi Q, Chu Q, Zeng Y, Yuan X, Wang J, Zhang Y, Xue C, Li L. Non-coding RNA methylation modifications in hepatocellular carcinoma: interactions and potential implications. Cell Commun Signal. 2023 Dec 18;21(1):359. doi: 10.1186/s12964-023-01357-0. PMID: 38111040; PMCID: PMC10726651.
[8] Zhou D, Tang W, Xu Y, Xu Y, Xu B, Fu S, Wang Y, Chen F, Chen Y, Han Y, Wang G. METTL3/YTHDF2 m6A axis accelerates colorectal carcinogenesis through epigenetically suppressing YPEL5. Mol Oncol. 2021 Aug;15(8):2172-2184. doi: 10.1002/1878-0261.12898. Epub 2021 Jan 25. PMID: 33411363; PMCID: PMC8333777.
[9] Ma J, Han H, Huang Y, Yang C, Zheng S, Cai T, Bi J, Huang X, Liu R, Huang L, Luo Y, Li W, Lin S. METTL1/WDR4-mediated m7G tRNA modifications and m7G codon usage promote mRNA translation and lung cancer progression. Mol Ther. 2021 Dec 1;29(12):3422-3435. doi: 10.1016/j.ymthe.2021.08.005. Epub 2021 Aug 8. PMID: 34371184; PMCID: PMC8636169.
[10] Lv X, Liu X, Zhao M, Wu H, Zhang W, Lu Q, Chen X. RNA Methylation in Systemic Lupus Erythematosus. Front Cell Dev Biol. 2021 Jul 7;9:696559. doi: 10.3389/fcell.2021.696559. PMID: 34307373; PMCID: PMC8292951.
[11] Dorn LE, Lasman L, Chen J, Xu X, Hund TJ, Medvedovic M, Hanna JH, van Berlo JH, Accornero F. The N6-Methyladenosine mRNA Methylase METTL3 Controls Cardiac Homeostasis and Hypertrophy. Circulation. 2019 Jan 22;139(4):533-545. doi: 10.1161/CIRCULATIONAHA.118.036146. PMID: 30586742; PMCID: PMC6340720.
[12] Han Z, Wang X, Xu Z, Cao Y, Gong R, Yu Y, Yu Y, Guo X, Liu S, Yu M, Ma W, Zhao Y, Xu J, Li X, Li S, Xu Y, Song R, Xu B, Yang F, Bamba D, Sukhareva N, Lei H, Gao M, Zhang W, Zagidullin N, Zhang Y, Yang B, Pan Z, Cai B. ALKBH5 regulates cardiomyocyte proliferation and heart regeneration by demethylating the mRNA of YTHDF1. Theranostics. 2021 Jan 1;11(6):3000-3016. doi: 10.7150/thno.47354. PMID: 33456585; PMCID: PMC7806463.
[13] Kumari R, Dutta R, Ranjan P, Suleiman ZG, Goswami SK, Li J, Pal HC, Verma SK. ALKBH5 Regulates SPHK1-Dependent Endothelial Cell Angiogenesis Following Ischemic Stress. Front Cardiovasc Med. 2022 Jan 20;8:817304. doi: 10.3389/fcvm.2021.817304. PMID: 35127873; PMCID: PMC8811170.
[14] Gao X, Liang X, Liu B, Hong Y, He H, Shen Y, Chen J, Huang X, Hu B, Li W, Li X, Zhang Y. Downregulation of ALKBH5 rejuvenates aged human mesenchymal stem cells and enhances their therapeutic efficacy in myocardial infarction. FASEB J. 2023 Dec;37(12):e23294. doi: 10.1096/fj.202301292R. PMID: 37966425.
[15] Jian D, Cheng X, Qi D, Wang S, Wang C, Shi Y, Li Z, Jin S, Jia Z, Teng P, Pei Z, Gu X, Jian L, Wang W, Yi X, Xing J, Tang H. Nsun2 controls cardiac homeostasis and hypertrophic response by regulating PRKACA expression. Theranostics. 2025 Jan 20;15(6):2393-2412. doi: 10.7150/.104441. PMID: 39990213; PMCID: PMC11840729.
[16] ang J, Zhou C, Ye F, Zuo S, Zhou M, Lu L, Chai P, Fan X. RNA methylation homeostasis in ocular diseases: All eyes on Me. Prog Retin Eye Res. 2025 Jan 27;105:101335. doi: 10.1016/j.preteyeres.2025.101335. Epub ahead of print. PMID: 39880118.
[17] Xiong J , Wu J , Liu Y ,et al.Quantification and mapping of RNA modifications[J].Trends in Analytical Chemistry, 2024, 172.DOI:10.1016/j.trac.2024.117606.